mRNA不止于疫苗(上):三大技术突破开启肿瘤与罕见病治疗新纪元
mRNA技术因新冠疫苗一战成名,但其潜力远不止于传染病防控。近年来,mRNA肿瘤疫苗技术蓬勃发展,并在个性化医疗、罕见病治疗等多个前沿医学领域中持续释放潜力。特别是自扩增mRNA(saRNA)、环状RNA(circRNA)以及基于AI算法设计的个性化疫苗,正在成为全球生物医药产业追逐的新高地。
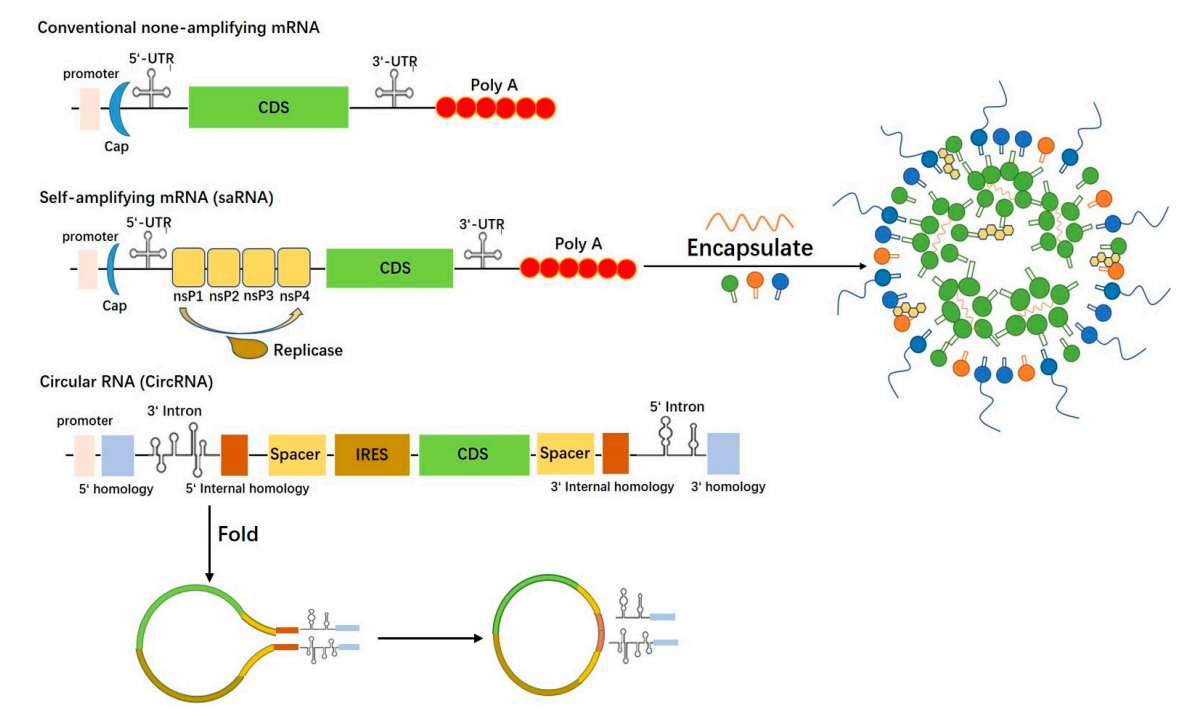
常规mRNA、saRNA 和 CircRNA 结构和封装示意图
(doi: 10.3390/v15081760.)
自扩增mRNA(saRNA)——长效表达的“智能工厂”
自扩增mRNA(saRNA)是一种融合病毒复制机制的先进mRNA平台。通过在传统mRNA结构中引入病毒复制酶编码序列,saRNA在细胞内不仅能够表达抗原蛋白,还能进行自我复制,从而大幅增强表达水平与免疫持续性。这种机制使得saRNA疫苗在进入宿主细胞后,相当于建立了一座“抗原制造工厂”,实现长时间、高强度的免疫刺激。
》技术亮点总结
- 低剂量高效表达:saRNA疫苗只需传统mRNA疫苗约1/10剂量,便可诱导可观的T细胞与抗体反应。
- 天然佐剂效应:扩增过程中产生的双链RNA可天然激活免疫应答(如STING通路),减少外加佐剂需求。
- 应用拓展:已在黑色素瘤、宫颈癌等肿瘤模型中验证疗效,并用于狂犬病、埃博拉等传染病疫苗研发。
当前,Moderna、CureVac等生物科技公司正在积极推进saRNA在肿瘤、传染病等多领域的应用。日本在2023年批准的首个saRNA新冠疫苗,也为其在临床应用中的安全性和可行性提供了初步验证。
环状RNA(circRNA)疫苗——稳定性与长效性的突破
环状RNA疫苗利用RNA连接酶技术,将线性mRNA首尾连接成闭环结构,消除5’帽和3’多腺苷酸尾,从而显著增强了对核酸酶的抵抗能力,提高了体内稳定性和抗原持续表达。
相比传统mRNA疫苗需要多次加强,circRNA疫苗能实现单剂长效表达,适用于慢性疾病、肿瘤及资源受限地区的免疫需求。通过优化内部结构,circRNA还能同时编码多个抗原或免疫调节因子,提升广谱性和治疗灵活性,尤其适合异质性肿瘤治疗。
在罕见病领域,circRNA同样展现潜力,如牛泰勒虫病动物模型中取得良好防控效果。中国科学院研发的寨卡病毒circRNA疫苗,实现单剂接种激发强效持久免疫且无交叉抗体增强风险,推动其在人类疫苗和罕见病治疗上的应用。
》技术亮点总结
- 单剂长效:环状结构赋予circRNA极佳的体内稳定性,单次接种即可实现持久免疫,避免传统mRNA疫苗的多次加强接种需求。
- 多抗原表达:通过优化启动子和连接序列,circRNA可编码多种抗原或免疫调节分子,增强肿瘤治疗的覆盖率和效果。
- 罕见病潜力:circRNA疫苗在多种动物模型中展现出优异的防控能力,为罕见病的疫苗开发提供了新的技术路径。
肿瘤个性化mRNA疫苗——精准医疗的里程碑
随着AI算法与新抗原筛选技术的迅速发展,肿瘤个性化mRNA疫苗正成为精准医疗的重要突破口。不同于“通用型”癌症疫苗,个性化mRNA疫苗以患者自身肿瘤的基因突变为靶点,通过全外显子测序(WES)定位独有新抗原,结合AI进行免疫原性预测与筛选,实现“一人一方”的定制治疗。
这一策略不仅提升了靶向精度,还可与其他免疫疗法协同增强治疗效果。与此同时,个性化疫苗的研发流程已高度自动化,从样本采集、基因测序到AI设计与生产,最快可在1–2周内完成,未来有望压缩至48小时,显著提升治疗效率与临床应用可行性。
》技术亮点总结
- AI驱动定制:结合全外显子测序与AI预测,实现“个体化靶点 + 高免疫原性”双重精准。
- 临床突破:mRNA-4157联合免疫疗法将黑色素瘤复发风险降低49%;mRNA-5671在KRAS突变癌种中展现潜力。
- 极速制造:流程自动化显著缩短生产周期,助力定制疫苗快速临床转化。
泓迅生物mRNA合成服务
“设计至交付,赋能mRNA高效稳定”
泓迅生物依托完备的Syno®合成平台,提供从模板合成到体外转录的全套RNA服务。经过密码子优化、5’加帽、3’加尾和核苷修饰,转录后的RNA可广泛应用于基因编辑、基因功能研究、基因诊断、结构研究和核酸疫苗开发等领域。

从新冠疫苗的爆发式应用,到肿瘤、罕见病等高难度疾病领域的深入探索,mRNA技术正以多样形态持续拓展应用边界。saRNA的低剂量高效、circRNA的长效稳定、AI个性化疫苗的精准靶向,不仅为肿瘤与罕见病治疗提供了全新可能,更将推动医学进入“按需定制”的新时代。
References
[1] Marcano, V.C.; Cardenas-Garcia, S.; Diel, D.G.; Antoniassi da Silva, L.H.; Gogal, R.M., Jr.; Miller, P.J.; Brown, C.C.; Butt, S.L.; Goraichuk, I.V.; Dimitrov, K.M.; et al. A Novel Recombinant Newcastle Disease Vaccine Improves Post- In Ovo Vaccination Survival with Sustained Protection against Virulent Challenge. Vaccines 9, 953 (2021).
[2] Cai, ML., Wu, YK., Mei, QX. et al. Observation of supersymmetry and its spontaneous breaking in a trapped ion quantum simulator. Nat Commun 13, 3412 (2022).
[3] Benvenuto, E., Broer, I., D’Aoust, MA. et al. Plant molecular farming in the wake of the closure of Medicago Inc. Nat Biotechnol 41, 893–894 (2023).
[4] Nassiri, F., Patil, V., Yefet, L.S. et al. Oncolytic DNX-2401 virotherapy plus pembrolizumab in recurrent glioblastoma: a phase 1/2 trial. Nat Med 29, 1370–1378 (2023).
[5] Yuan Y, Gao F, Chang Y, Zhao Q, He X. Advances of mRNA vaccine in tumor: a maze of opportunities and challenges. Biomark Res.18;11(1):6 (2023).
[6] Zhou W, Jiang L, Liao S, Wu F, Yang G, Hou L, Liu L, Pan X, Jia W, Zhang Y. Vaccines' New Era-RNA Vaccine. Viruses.18;15(8):1760 (2023).
 Syno®C 引物合成
Syno®C 引物合成 RNA合成
RNA合成 mRNA合成
mRNA合成 Syno®GS 基因合成
Syno®GS 基因合成 载体构建
载体构建 高通量及DNA文库构建
高通量及DNA文库构建 CRISPR基因编辑平台
CRISPR基因编辑平台 病毒包装
病毒包装 基因测序及分析
基因测序及分析 重组蛋白表达平台
重组蛋白表达平台 抗体工程平台
抗体工程平台 多肽服务
多肽服务 生物信息学分析与设计
生物信息学分析与设计 CRISPR文库
CRISPR文库 合成生物学产品
合成生物学产品 ProXpress蛋白快速检测
ProXpress蛋白快速检测 CRISPR 质粒
CRISPR 质粒





















