蛋白质工程新篇 | AI Design&无细胞蛋白合成系统
人工智能(AI)正在彻底改变蛋白质设计领域,借助深度学习,科学家能够设计出前所未有的酶、生物材料和药物蛋白。然而,将计算机生成的序列转化为实际功能仍需实验验证。传统依赖活细胞的蛋白表达流程周期长、通量低,且难以表达有毒或复杂蛋白,已成为AI赋能落地的瓶颈。
无细胞蛋白合成系统跳出了活细胞的限制,直接在体外利用细胞提取物合成目标蛋白,如同将细胞内的生命合成“生产线”搬到了试管中。
细胞体系vs. 无细胞体系:瓶颈与突破
传统细胞体系的局限
尽管工程微生物或细胞系作为蛋白质生产的“工厂”已有数十年历史,但活细胞的天生局限在AI时代被进一步放大。细胞生长速度、营养消耗、代谢副产物积累等因素均会影响生产;培养过程对无菌环境要求严苛,放大规模时风险增加。最关键的是,细胞是一个以自身生存为最高准则的系统。如果外源目标蛋白对其有毒性或干扰正常代谢,细胞会通过降低表达、甚至停止生长来对抗。这导致开发周期长、表达效率不稳定、普适性差。当AI能轻松生成成百上千个候选序列时,传统的细胞工厂却无法进行与之匹配的高通量并行制造,瓶颈尤为突出。
无细胞体系的突破性优势
无细胞蛋白质合成(CFPS)提供了截然不同的路径。它提取细胞内部的转录、翻译核心machinery(如核糖体、tRNA、相关酶与能量系统),在体外试管环境中,直接以DNA或mRNA为模板合成蛋白质。由于无需维持细胞存活,CFPS展现出独特优势:
-
开放与可控:反应体系完全开放,研究者可自由调整离子强度、辅因子浓度,甚至直接添加非天然氨基酸或合成生物学元件,不受细胞膜屏障和体内调控机制的限制。
-
快速与高效:省去了克隆构建与细胞培养的漫长步骤,一个典型的CFPS反应在几小时内即可完成目标蛋白的合成。
-
高通量与并行化:无需分别培养多个菌株,仅需提供不同的DNA模板,即可在96或384孔板中同时合成数十至数百种不同蛋白质,极其适合与AI设计联动的迭代筛选。
-
通用性与灵活性:可采用原核(如大肠杆菌提取物)或真核(如小麦胚芽、兔网织红细胞)系统,满足不同蛋白(包括某些需简单翻译后修饰的蛋白)的表达需求。
-
便携性与分布式生产:体系易于冻干储存和运输,可在需要时现场激活进行生产,为分布式生物制造与现场诊断提供了可能。
一言以蔽之,无细胞合成突破了“细胞工厂”的传统模式,将分散的细胞内“小作坊”整合为体外可控的“规模化生产线”,为蛋白质工程赋予了前所未有的自由度。
核心维度对比下面我们以一张表格总结传统细胞体系与无细胞体系在若干关键维度上的对比:

AI与无细胞:强强联合的协同效应
AI已在蛋白质结构预测、序列生成与功能设计方面展现出强大威力,成为当之无愧的“创意引擎”。它能够快速探索远超天然多样性的序列空间,提出海量候选分子。过去依赖细胞体系,一次测试几十个变体已是负担,显然无法承接AI喷薄而出的设计洪流。这正是无细胞体系的价值所在:它有潜力成为连接数字世界与物理实体的高效桥梁,将AI的海量设计方案快速转化为可测试的真实分子。
将人工智能的设计能力与无细胞体系的快速合成能力相结合,被视为突破蛋白质工程瓶颈的关键。AI是“加速器”,负责产生创意;无细胞是“释放器”,负责将创意快速现实化。二者协同,产生的效应远大于简单相加。

1. 极大加速设计迭代循环
无细胞体系将传统“设计-构建-测试”周期从数周压缩至数小时。研究人员可在一天内完成从DNA模板到蛋白合成与活性检测的全流程,实现“设计-验证-优化”的次日迭代,极大提升了研发效率。
2. 完美承接AI的高通量输出
无细胞系统天然适配高通量操作,可在微孔板中并行合成与测试AI生成的数十至上百个候选序列,有效规避细胞培养中的交叉污染与生长差异问题,从而实现大规模、系统化的快速筛选与优化。
3. 共同突破天然生物学的限制
AI可设计含非天然氨基酸或特殊结构的“非自然”蛋白,而活细胞往往难以表达此类分子。无细胞体系无生存压力,可通过外源添加非天然底物或辅因子,直接合成这些特殊蛋白,极大拓展了AI的设计边界。
4. 构建数据驱动的学习闭环
无细胞系统不仅是验证工具,更是高质量数据源。其所获得的蛋白活性、表达量等数据可实时反馈至AI模型,用于优化后续设计。更进一步,AI亦可反向优化无细胞体系反应条件,形成“设计-构建-测试-学习”的强化回路,推动系统持续进化。
综上所述,人工智能与无细胞蛋白合成的结合,打通了从“比特”到“原子”的快速通道。计算侧的海量创意不再受限于缓慢的实验验证,而高速的实验反馈又持续滋养和提升着计算模型。这种协同正在催生质的飞跃,加速新药、新酶、新生物材料的发明进程。
产业格局与未来展望
技术成熟度曲线正将“AI+无细胞”从前沿科研推向产业应用,孕育出一个快速增长的新兴市场。QYResearch调研显示,2023年全球无细胞蛋白表达市场销售额达到了15亿元,预计2030年将达到23亿元,年复合增长率(CAGR)为6.2%(2024-2030)。这背后是制药、生物技术领域对快速蛋白质开发工具的迫切需求。

当然,迈向大规模产业化仍面临挑战:
- 复杂蛋白表征:对于需要复杂翻译后修饰(如精确糖基化)的蛋白(如某些治疗性抗体),无细胞体系的产物与天然产物的一致性仍需不断提升。
- 成本与供应链:核心试剂成本仍是制约因素。但随着需求增长、工艺优化及规模化生产,成本将持续下降。可重复使用或连续流CFPS系统也将提升经济性。
- 人才与范式转变:新范式要求团队同时精通AI计算、生物学与自动化实验操作,对研发组织结构和人才培养提出了新要求。
我们正站在一场生物工程范式转变的起点。AI赋能设计,无细胞赋能快速实现,两者结合将生物创制效率提升了一个数量级。学术上,它让我们能更自由地探索“序列-结构-功能”的未知领域;产业上,它有望大幅缩短新药与新材料的研发周期,降低成本。未来5-10年,随着AI算法更精准、无细胞平台更高效、更经济,这一组合将从“前沿技术”变为生物制造的“标准配置”。
结语:开启蛋白质工程的新大门
AI与无细胞蛋白合成的融合,为蛋白质工程开启了新的大门。AI是创意的源泉,无细胞是实现的高效装置。两者协同,克服了传统细胞体系的根本性瓶颈,在研发速度与设计广度上实现了双重飞跃。
为响应AI驱动蛋白设计的快速发展,泓迅生物推出无细胞蛋白表达服务平台。若你正筹划把AI生成的序列快速落地验证,或需要从 DNA→RNA→Protein 的端到端交付,我们就是能让项目“明天更快一点”的那双手:
- AI-powered CFPS:2小时检测、并行筛选、条件可调、难表达/有毒蛋白更友好。
- 基因与寡核苷酸合成:超百亿碱基经验、复杂序列攻关、100%准确交付与经济交期。
- 多平台蛋白表达/制备:无细胞/细菌/酵母/昆虫/哺乳动物齐备,定制载体/宿主/标签策略。
- 一站式合成生物服务:从基因合成、CRISPR文库构建、病毒包装到RNA与抗体服务,我们提供覆盖“DNA→RNA→Protein”全流程的研发支持。
- 合规与团队:200+科研人员、制造级质量体系,面向药物、诊断、材料等多场景落地。
当AI这台强力引擎安装到无细胞这个灵活底盘上,生命科学创新的跑车将驶向更广阔的天地。让AI的创造力与无细胞的执行力在同一条生产线上汇合——把序列交给我们,把时间赢回来。
为什么选择泓迅
领先的技术优势—AI赋能的合成生物学技术
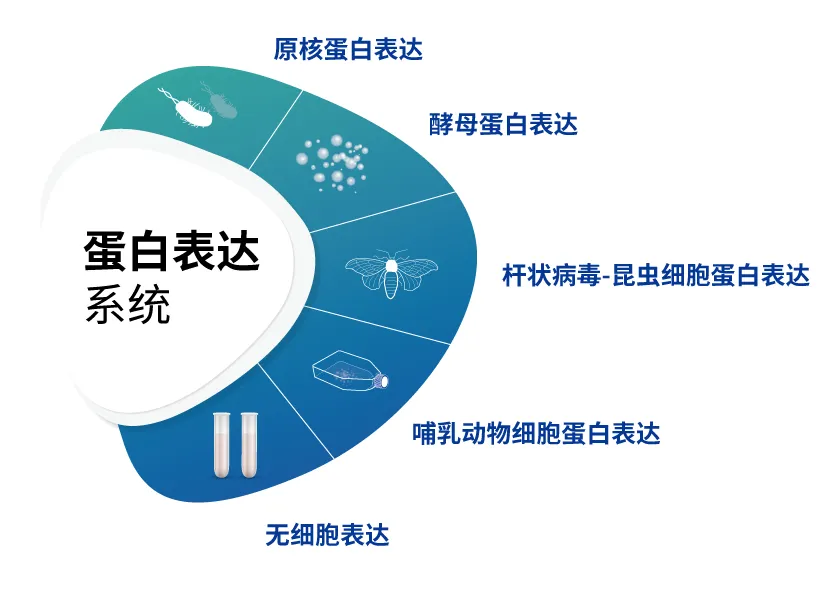
成熟的蛋白表达经验——五大蛋白表达系统,自主研发数十种高效表达载体
更高的价值服务—一站式生物分子解决方案

 Syno®C 引物合成
Syno®C 引物合成 RNA合成
RNA合成 mRNA合成
mRNA合成 Syno®GS 基因合成
Syno®GS 基因合成 载体构建
载体构建 高通量及DNA文库构建
高通量及DNA文库构建 CRISPR基因编辑平台
CRISPR基因编辑平台 病毒包装
病毒包装 基因测序及分析
基因测序及分析 重组蛋白表达平台
重组蛋白表达平台 抗体工程平台
抗体工程平台 多肽服务
多肽服务 生物信息学分析与设计
生物信息学分析与设计 CRISPR文库
CRISPR文库 合成生物学产品
合成生物学产品 ProXpress蛋白快速检测
ProXpress蛋白快速检测 CRISPR 质粒
CRISPR 质粒





















