mRNA疫苗:精准高效,引领疫苗科技革命
mRNA疫苗是以病原体的抗原蛋白对应的mRNA结构为基础,通过不同的递送方式递送至人体细胞内,经翻译后能刺激细胞产生抗原蛋白、引发机体特异性免疫反应的疫苗产品。
mRNA两大作用
• 抗原递呈作用: 相较于蛋白质相关疫苗而言,胞质内少量mRNA分子就可以实现抗原递呈到CTL细胞,而蛋白质只能依赖效率较低的交联提呈途径。机体可以通过mRNA可持续地获得抗原,在抗体广度和亲和力方面显著优于蛋白质相关疫苗,带来更持久的保护。此外,mRNA相较蛋白质可递呈抗原种类更丰富,能编码全长蛋白质,因此可避免病人MHC半抗原限制。同时,通过串联结构设计可以将多种抗原表型组装在一条mRNA链中。
• 自佐剂作用: 内体中的mRNA会被多种模式识别受体(PRR)识别,这些PRR广泛分布于细胞质和内体膜上,能够感知并响应包括病毒RNA在内的多种病原体相关分子模式(PAMPs)。一旦mRNA被PRR识别,会触发一系列信号转导级联反应,这些反应最终激活转录因子,如干扰素调节因子(IRFs)和核因子κB(NF-κB),进而促进特定基因的转录。
mRNA疫苗的优势
mRNA疫苗具有很多得天独厚的优势,是促进其被广泛研究和应用的主要原因。容易制备是mRNA疫苗脱颖而出的主要原因之一,其活性成分RNA形式简单,通常以线性DNA为模板通过体外转录获得,在这个过程中通过密码子优化、核苷修饰、以及辅助递送系统等方式可提高mRNA的稳定性及翻译效率,从而形成特异性高、稳定性强的核酸疫苗。mRNA疗法整体工艺简单,研发速度快,稳定性高。 由于IVT mRNA是在无细胞体系中生产的,因此临床级mRNA的工艺开发和生产可以轻易地建立标准化体系。
mRNA疫苗应用领域
1. 抗肿瘤mRNA疫苗
抗肿瘤mRNA疫苗根据作用机理分为两类:基于树突状细胞(DC)给药的mRNA 疫苗和直接注射的mRNA疫苗。
(1)DC疫苗:通过体外转录后的mRNA转染至DC后,在细胞质中翻译形成抗原,和DC细胞作用激活DC细胞。将已激活的DC细胞注入人体,激发体内免疫系统应答,达到杀死肿瘤细胞的目的。
(2)直接注射的mRNA疫苗:以粒细胞-巨噬细胞集落刺激因子(GM-CSF)作为佐剂,将编码相关抗原的mRNA皮下注射入患者体内,从而刺激机体产生抗原抗体,抑制癌细胞的增长。
2. 传染病mRNA疫苗
针对传染性病原体开发预防性疫苗是控制和阻止流行病大规模爆发的关键。传统的疫苗通常建立在整个病毒株的基础之上,包括减毒疫苗、灭活疫苗,也有基于病毒蛋白亚单位的重组蛋白疫苗。虽然这些传统疫苗在许多疾病的预防上起到了重要作用,但是面对急性爆发的传染病,例如此次的新型冠状病毒,传统疫苗的研发和生产周期太长,难以满足控制疫情的需要,因此需要更加有效、更加通用的疫苗开发平台,而mRNA疫苗就是破局的一个潜在方案。mRNA疫苗能够靶定病毒的保守区域,直接在细胞中表达产生特定抗原,激活机体的免疫应答产生抗体,从而达到预防传染性疾病的目的。
3. 针对罕见病的mRNA疫苗
除肿瘤和传染性病外,mRNA疫苗同样应用于罕见病治疗领域,如Moderna公司用于治疗甲基丙二酸血症(MMA)的 mRNA-3704 和治疗丙酸血症(propionic acidemia,PA)的 mRNA-3927 等。
泓迅生物
一站式RNA体外转录解决方案合作伙伴
泓迅生物凭借自主研发的NG Codon TM 密码子优化软件结合完备的Syno®合成平台,可提供针对sgRNA, lncRNA, mRNA等不同类型RNA的从模板合成到体外转录的全套服务。经过密码子优化、5’加帽、3’加尾、核苷修饰等一系列序列优化过程,转录后的RNA分子可应用于多种研究场景,如基因编辑、基因功能研究、基因诊断、结构研究、核酸疫苗开发等。
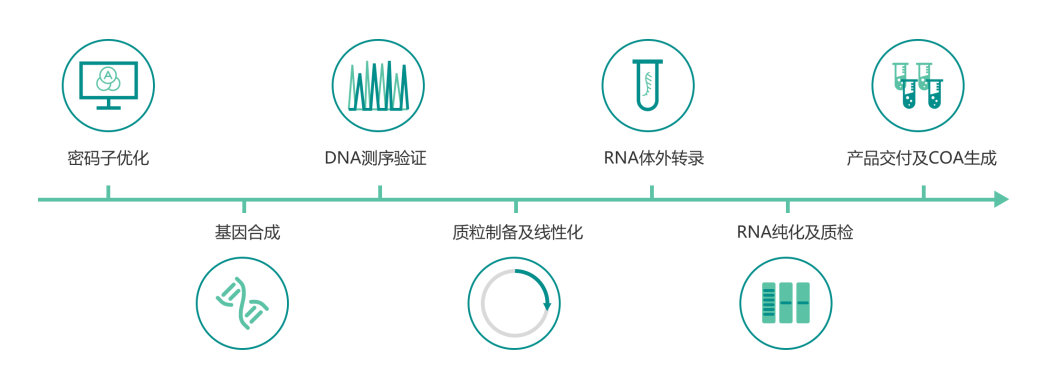
体外转录流程图
现货产品
| 产品编号 | 序列名称 |
|---|---|
|
E2021004 |
EGFP mRNA |
|
L2021010 |
Luciferase mRNA |
|
C2021004 |
Cas9 mRNA |
参考文献
1. Jan D. Beck et al. mRNA therapeutics in cancer immunotherapy. Molecular Cancer. 2021. 20: 69.
2. Stadler, C.R. et al. Elimination of large tumors in mice by mRNA-encoded bispecific antibodies. Nat Med. 2017. 23, 815-817.
3. 于晴, 黄婷婷, 邓子新. 微生物药物产业现状与发展趋势. 中国工程科学. 2021. 23(5):69-78.
 Syno®C 引物合成
Syno®C 引物合成 RNA合成
RNA合成 mRNA合成
mRNA合成 Syno®GS 基因合成
Syno®GS 基因合成 载体构建
载体构建 高通量及DNA文库构建
高通量及DNA文库构建 CRISPR基因编辑平台
CRISPR基因编辑平台 病毒包装
病毒包装 基因测序及分析
基因测序及分析 重组蛋白表达平台
重组蛋白表达平台 抗体工程平台
抗体工程平台 多肽服务
多肽服务 生物信息学分析与设计
生物信息学分析与设计 CRISPR文库
CRISPR文库 合成生物学产品
合成生物学产品 ProXpress蛋白快速检测
ProXpress蛋白快速检测 CRISPR 质粒
CRISPR 质粒





















