小核酸药物化学合成平台: siRNA
小核酸药物的春天来了?
小核酸药物全球市场规模从2016年0.1亿美元已增长至2021年32.5亿美元,年复合增长率高达217.8%,预计到2025年全球小核酸药物销售额将突破100亿美元。截至目前,全球已有15款小核酸药物上市,还有近300款药物在研发阶段,其中60%仍处于临床前阶段。小核酸药物行业静待花开!
获批上市的小核酸药物汇总
| 时间 | 药物 | 公司 | 适应症 | 类别 |
|---|---|---|---|---|
| 1998 | Vitravene | Ionis/Novartis | 巨细胞病毒性视网膜 | ASO |
| 2004 | Macugen | Eyetech/Pfizer | 新生血管性黄斑病变性 | Aptamer |
| 2013 | Kynamro | Sanofi/Ionis | 纯合子型家族性高胆固血症 | ASO |
| 2016 | Eteplirsen | Sarepta | 杜氏肌营养不良症 | ASO |
| 2016 | Spinraza | Biogen/Ionis | 脊髓型肌萎缩症 | ASO |
| 2018 | Tegsedi | Ionis | 遗传性转甲状腺素蛋白淀粉样变性 | ASO |
| 2018 | Onpattro | Alnylam | 家族性淀粉样多发性神经病变性 | siRNA |
| 2019 | Wayliv | Ionis | 家族性乳糜微粒血症综合征 | ASO |
| 2019 | Vyondys 53 | Sarepta | 肚氏肌营养不良症 | ASO |
| 2019 | Givosiran | Alnylam | 急性肝卟啉症 | siRNA |
| 2020 | Viltepso | Nippon Shinyaku | 肚氏肌营养不良症 | ASO |
| 2020 | Leqvio | Alnylam/Novartis | 型高胆固醇血症及混合血脂异常 | siRNA |
| 2020 | Oxlumo | Alnylam | 原发性高草酸尿症I型 | siRNA |
| 2021 | Amondys 45 | Sarepta | 杜氏肌营养不良症 | ASO |
| 2021 | Vutrisiran | Alnylam | 遗传性ATTR (hATTR) 淀粉样变性 | siRNA |
小核酸药物是一种从基因转录后、蛋白质翻译前阶段进行调控的疗法,作用于蛋白质合成上游。相比现有小分子和抗体药物,在转录水平上实现对疾病的治疗,不受不可成药蛋白的制约、治疗效率高、特异性强、作用靶点多、研发成功率高,具有不可限量的发展潜力。目前全球小核酸药物平均每年获批约2款,占FDA批准药物总数的5%左右,其处境类似20年前的抗体药物。春天的到来,必然要经受得住寒冬的考验。
小核酸药物研发仍然存在部分技术难关有待突破,包括RNA设计、化学修饰、肝脏以外组织的特异性递送难题、脱靶毒性及药物规模性生成等问题。一旦技术问题实现突破,小核酸药物有望迎来行业快速发展阶段,成为继小分子和抗体药物之后的第三类主流药物。
siRNA药物
从药物管线来看,基本可以分为ASO和siRNA两大药物类型。在现阶段获批上市的15款小核酸药物中,ASO药物9款、siRNA药物5款、Aptamer药物1款。ASO和siRNA同属小核酸药物家族,他们各有千秋。
| 类型 | ASO | siRNA |
|---|---|---|
| 分子结构 | 单链的核苷酸分子 | 互补的双链RNA分子 |
| 作用机制 | ASO药物通过与目标基因mRNA结合以阻止其翻译为蛋白质。 | siRNA药物通过与目标mRNA结合并诱导RNA干扰来降解mRNA。 |
| 特异性 | ASO药物特异性相对较高,易于针对特定的mRNA进行治疗。 | siRNA药物的特异性略低,因为它们可能与附近的基因结合。 |
| 药物效果 | ASO药物仅阻止mRNA的翻译,而不降解mRNA。 | siRNA药物具有更长的药物效果,因为它们可以在体内停留更长的时间。 |
总的来说,ASO药物和siRNA药物都是潜在有效的RNA干扰技术,与ASO相比,siRNA的优点在于可以反复多次引导靶mRNA切割,具有更高的效率。具体选择哪种干扰方式,取决于研究人员对特定疾病的研究和理解,以及对药物的针对性需求。
siRNA发展历程
siRNA是与靶基因互补的长度为21-25nt的小片段双链RNA。目前,siRNA技术已经成为研究和治疗各种疾病的重要工具,包括癌症、病毒感染、遗传性疾病等。同时,siRNA技术也在不断发展,如引入化学修饰、载体等改进措施,以提高siRNA的稳定性和生物活性。
》1998年,由Andrew Fire和Craig Mello等科学家发现,他们发现双链RNA(dsRNA)可以介导RNA干扰(RNAi),通过切割靶向mRNA的siRNA来抑制基因表达。这项研究引起了科学界的广泛关注,并使RNAi成为热门研究领域。
》2001年,Elbashir等人首次报道了使用合成的siRNA分子实现RNA干扰的方法,并成功抑制了EGFP基因的表达。随后,siRNA技术被广泛用于基因沉默、基因功能研究和潜在的治疗应用等领域。
》2006年,Alnylam Pharmaceuticals公司研制出了第一种临床前siRNA药物,用于治疗RPI基因表达异常导致的疾病。
》截至2022年,Alnylam公司共有四款RNAi疗法获得美国FDA的批准上市。这些药物分别是用于治疗淀粉样变性病的Onpattro,用于治疗原发性高胆固醇血症的Givosiran,用于治疗原发性高草酸尿症I型的Oxlumo(lumasiran)以及用于遗传性ATTR(hATTR)淀粉样变性的Vutrisiran。
siRNA作用机制
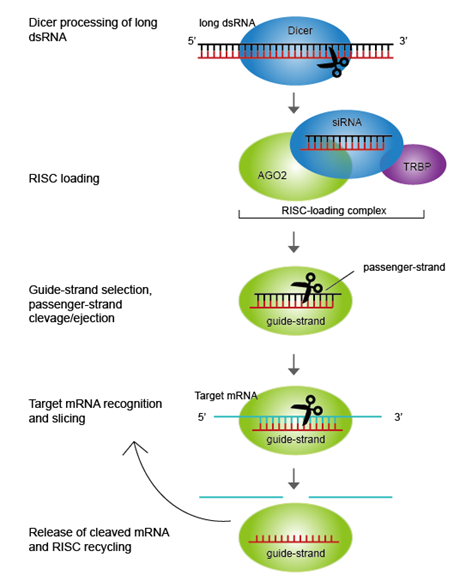
siRNA分子由21-23个核苷酸组成,由一个富含腺嘌呤(A)和胸腺嘧啶(U)的双链RNA组成。siRNA能够在胞质中结合到RISC(RNA诱导沉默复合物)中,并与RISC中的蛋白酶一起将其单链化。siRNA的作用机制可分为以下步骤:
1. siRNA与RISC复合物结合:siRNA进入细胞后,与RISC(RNA诱导的沉默复合物)复合体结合,形成“活性RISC复合物”。
2. siRNA解旋并与目标mRNA互补配对:RISC复合物解旋siRNA,将其中的单链RNA(“导引链”)与靶mRNA的互补区域配对。该配对主要是由siRNA的5'端部分与目标mRNA的3'端非翻译区(UTR)的互补区域结合,形成RNA-RNA双链复合物。
3. 靶mRNA切割或翻译抑制:RISC复合物中的“核酸酶活性中心”利用导引链作为模板,对靶mRNA进行特定位置的剪切,从而破坏其结构,并导致其降解或者翻译受到抑制。这种特异性的靶向降解或翻译抑制是siRNA的关键作用机制。
siRNA化学修饰
siRNA(小干扰RNA)是一种用于基因靶向治疗的有效工具,但其在细胞内的稳定性、传递效率、特异性等方面仍然存在一些挑战。因此,对siRNA进行化学修饰是提高其生物利用度和临床应用价值的重要途径。siRNA化学修饰的方法主要包括以下几种:
1. 磷酸二酯键修饰:通过化学改变siRNA磷酸二酯键的结构,可以提高siRNA在细胞内的稳定性和抗核酸酶降解的能力。常见的修饰包括2'-氧甲基(2'-O-Me)、2'-氟(2'-F)和磷酸二酯胆碱(PC)等。
2. 核苷酸碱基修饰:将siRNA的核苷酸碱基进行修饰,可以提高其与mRNA的配对效率和特异性。常见的修饰包括2'-氧甲基、2'-氨基和N-甲基二异硫脲等。
3. siRNA末端修饰:在siRNA的3'端或5'端引入化学修饰基团,可以改变siRNA的结构和亲水性,从而提高siRNA在细胞内的稳定性。常见的修饰包括羟基(OH)、磷酸二酯基(PO4)和胆碱基(Chol)等。
4. 胺基酸修饰:在siRNA中引入胺基酸修饰,可以提高siRNA在细胞内的特异性。常见的修饰包括N-乙酰半胱氨酸(Ac-Cys)和N-乙酰赖氨酸(Ac-Lys)
需要注意的是,siRNA化学修饰虽然可以提高其生物利用度和临床应用价值,但也可能对siRNA的靶向性和安全性产生影响。因此,需要根据具体应用情境和研究需要,综合考虑化学修饰的选择和优化。
siRNA递送方式
siRNA在细胞内的递送是一个重要的挑战。目前常用的siRNA递送方式主要包括以下几种:
1) 载体介导递送:利用纳米粒子等载体将siRNA包装成复合物,以提高其细胞膜穿透能力和抗核酸酶降解的能力。载体主要分为病毒载体和非病毒载体。病毒载体效率较低且进入人体后会引起免疫反应,现在使用较少。非病毒载体中较为常用的是纳米颗粒和缀合物偶联。这种方法适用于In vitro和In vivo的实验。
2) 靶向递送:通过利用针对肿瘤细胞表面分子的抗体、蛋白质或低分子量化合物等物质,将siRNA导向到肿瘤细胞中,提高siRNA的靶向性。常用的靶向物质包括RGD肽、抗HER2抗体等。这种方法适用于In vivo的实验。
3) 直接注射递送:将siRNA溶解在盐水、PBS等缓冲液中,通过直接注射到肿瘤组织或其他组织中,以达到直接传递siRNA的目的。这种方法比较简便,适用于In vivo的实验。
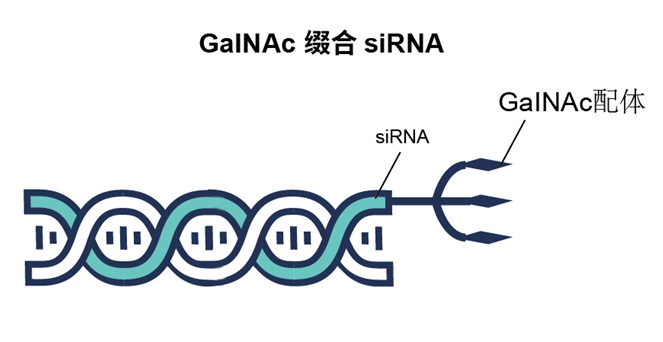
不同的siRNA递送方式有其各自的优缺点和适用范围。在具体应用时需要根据实验需要和研究目的进行选择和优化。同时,siRNA递送还存在一些挑战,如细胞毒性、免疫反应和生物稳定性等问题,需要继续加强研究。缀合物偶联递送系统因具有较显著的药效和安全性在众多递送系统中脱引而出。截止2022年,已有3款基于GalNac偶联递送系统的药物获批上市。GalNAc 作为亚洛曲蛋白受体(ASGPR)的配体,是一种特异性高表达于肝细胞膜表面的内泌受体,几乎没有由其他细胞表达,因此也主要用于肝脏给药。
泓迅生物助力siRNA药物研发
泓迅生物拥有标准的生产流程,领先设计与先进制造,为客户提供优质的siRNA化学合成平台!多种siRNA修饰类型与定制化寡核苷酸偶联物,µg-g级合成规格,满足您从研发级别到制造级别的应用需求。
siRNA合成
| 服务类型 | 服务内容 | 规格 | 纯化方式 | 周期 |
|---|---|---|---|---|
| siRNA合成 | siRNA NC FAM | 2.5 noml | HPLC/OPC | 现货 |
| siRNA NC | 2.5 noml | 现货 | ||
| 普通siRNA | 2.5 noml起 | 5-7天 | ||
|
化学修饰或荧光标记siRNA(P=S,2-OMe,2’-F, Thiol,Chol,Biotin,FAM,Cy5,Cy3,等) |
咨询 | 7-9天 | ||
| siRNA“三保一”套餐 | 3条siRNA(可加荧光) | 5 noml | HPLC/OPC | 5-7 |
| siRNA NC FAM | 2.5 noml | |||
| siRNA NC | 2.5 noml | |||
| siRNA positive control | 2.5 noml | |||
| 转染试剂 | 100 μL | |||
| siRNA“四保一”套餐 | 4条siRNA(可加荧光) | 5 noml | HPLC/OPC | 5-7 |
| siRNA NC FAM | 2.5 noml | |||
| siRNA NC | 2.5 noml | |||
| siRNA positive control | 2.5 noml | |||
| 转染试剂 | 100 μL |
我们可根据客户提供的基因序列、Gene ID或Accession Number,免费设计三/四条siRNA,交付的产品保证至少一对可以有效的抑制相应基因的表达,即mRNA水平的抑制效率在70%以上(转染效率至少达90%)。
siRNA筛选
| 服务类型 | 服务内容 | 周期 |
|---|---|---|
| siRNA筛选 | 细胞转染及优化实验 | 咨询 |
|
双荧光素酶报告基因系统筛选有效siRNA, 荧光定量PCR检测mRNA水平的沉默效率 |
||
| Western Blot检测蛋白情况 |
泓迅生物为客户提供有效的siRNA筛选服务,提供的实验报告包括:实验方法、步骤、照片及相关数据等。
定制化GaINAc修饰偶联物
| 产品名称 | 规格 | 交付周期 | 价格 |
|---|---|---|---|
| GalNac-siRNA | 研发级别(µg-mg) 制造级别(g) | 2周起 | 咨询 |
| GalNac-ASO | |||
| GalNac-microRNA |
泓迅生物可根据客户需求提供GalNac递送分子合成、定制化GalNac修饰偶联物,产品包括GalNac-siRNA、GalNac-ASO、GalNac-microRNA等。
References
1. Hu B, Zhong L, Weng Y, Peng L, Huang Y, Zhao Y, Liang XJ. Therapeutic siRNA: state of the art. Signal Transduct Target Ther. 2020 Jun 19;5(1):101. doi: 10.1038/s41392-020-0207-x.
2. Paunovska K, Loughrey D, Dahlman JE. Drug delivery systems for RNA therapeutics. Nat Rev Genet. 2022 May;23(5):265-280. doi: 10.1038/s41576-021-00439-4.
3. Elbashir SM, Lendeckel W, Tuschl T. RNA interference is mediated by 21- and 22-nucleotide RNAs. Genes Dev. 2001 Jan 15;15(2):188-200. doi: 10.1101/gad.862301.
4. Chen X, Mangala LS, Rodriguez-Aguayo C, Kong X, Lopez-Berestein G, Sood AK. RNA interference-based therapy and its delivery systems. Cancer Metastasis Rev. 2018 Mar;37(1):107-124. doi: 10.1007/s10555-017-9717-6.
5. Whitehead KA, Langer R, Anderson DG. Knocking down barriers: advances in siRNA delivery. Nat Rev Drug Discov. 2009 Feb;8(2):129-38. doi: 10.1038/nrd2742.
 Syno®C 引物合成
Syno®C 引物合成 RNA合成
RNA合成 mRNA合成
mRNA合成 Syno®GS 基因合成
Syno®GS 基因合成 载体构建
载体构建 高通量及DNA文库构建
高通量及DNA文库构建 CRISPR基因编辑平台
CRISPR基因编辑平台 病毒包装
病毒包装 基因测序及分析
基因测序及分析 重组蛋白表达平台
重组蛋白表达平台 抗体工程平台
抗体工程平台 多肽服务
多肽服务 生物信息学分析与设计
生物信息学分析与设计 CRISPR文库
CRISPR文库 合成生物学产品
合成生物学产品 ProXpress蛋白快速检测
ProXpress蛋白快速检测 CRISPR 质粒
CRISPR 质粒





















